1型糖尿病,又称胰岛素依赖型糖尿病,多发生在儿童和青少年期,也可发生于各种年龄。发病比较急剧,体内胰岛素不足,容易发生酮症酸中毒,必须用胰岛素治疗才能起到疗效,否则将危及生命。发病原因主要包括:自身免疫系统缺陷、遗传因素、病毒感染诱导产生、以及药物引起等,目前治疗1型糖尿病通用方式是采用胰岛素治疗,并且需要终身使用胰岛素,愈后需要严格控制,稍有不慎就会导致一些并发症的发生,如果停止治疗,随时会危及患者生命。
目前科研人员正在开发另外一种治疗1型糖尿病的方法,通过脐血干细胞,利用其再生医学的特点,对1型糖尿病患者进行治疗,本文我们就着重探讨脐血干细胞在治疗1型糖尿病中的独特机制以及应用前景。

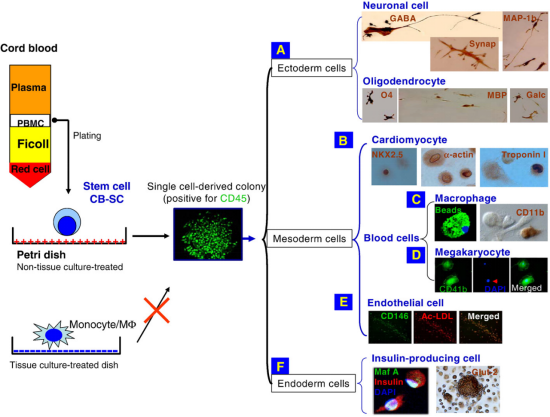
首先,干细胞本身在机体中与其他细胞具有很高的同源性,并且有助于组织的分化、再生、发育、重塑以及补充老化或者患病组织。很多证据表明,干细胞具有很强的免疫调节功能,可控制T1D的自身免疫疾病的发生,在T1D衍生的效应T细胞以及Treg细胞与CB-SC或者MSC共培养实验中,在此微环境中产生有利的可溶性因子。那么干细胞本身在治疗1型糖尿病中也主要围绕三个机理,一是自身免疫系统的控制,二是胰岛β细胞群的保护,三是克服产生胰岛素的细胞的短缺。
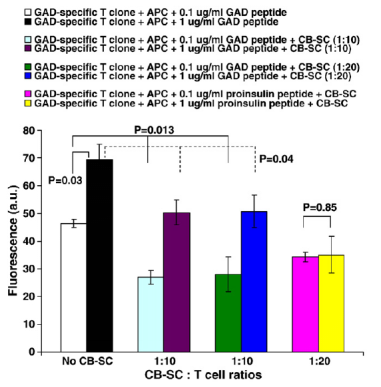
在健康来源的T细胞中CB-SC通过表面分子程序凋亡配体-1(PDL1)和分泌的一氧化氮显示对 CD4+ T 细胞和 CD8+ T 细胞的免疫调节作用。同时CB-SC 可以显著抑制有丝分裂原植物血凝素 (PHA) 刺激的淋巴细胞的增殖。为了进一步确定 CB-SC 在 T1D 中的治疗潜力,科研人员探索了 CB-SC 对从 T1D 患者产生的胰岛 β 细胞谷氨酸脱羧酶 (GAD) 特异性 CD4+ T 细胞克隆的直接调节。结果表明,与不存在 CB-SC 的对照组相比,存在 CB-SC 的情况下,用抗原呈递细胞 (APC) 和不同剂量的 GAD 肽刺激的该 T 细胞克隆的增殖显著且特异性地降低。通过对羧基荧光素琥珀酰亚胺酯 (CFSE) 标记的 T 细胞进行流式细胞术进一步证实了这种抑制。因此,这些数据表明 CB-SC 具有抑制 GAD 特异性 T 细胞的潜力。
人脐带血含有几种潜在的内皮生成细胞,可能有助于受损胰岛的血管生成和血管重建。例如,脐血来源的EPCs在体内血管生成中的潜力,脐带血中EPCs形成的血管的能力,可持续时间超过4个月。通过向内皮细胞分化,人脐血干细胞在血管修复和再生治疗方面具有相当大的潜力。人们利用共培养模型观察到,脐带血来源的干细胞可以通过分泌营养分子,包括白介素-6 (IL-6)、血管内皮生长因子- a (VEGF-A)、肝细胞生长因子(HGF)、转化生长因子- β (tgf - β)、提高胰岛的存活率、功能和血管生成/重建。体外数据同时也表明,在VEGF治疗的存在下,CB-SC可以诱导变成内皮祖细胞,进而促进血管生成。
自脐带血于1988年首次完成同胞供体脐血移植以来,脐血作为一种安全有效的移植供血来源,未来在临床应用中会有更广阔的前景。脐带血中有不同类型的干细胞,在处理T1D治疗的许多方面有很大的希望。那相信未来会有更广阔的应用前景。
参考文献:
1、Robertson RP. Islet transplantation a decade later and strategies for filling a halffull glass. Diabetes 2010;59:1285–91.
2、蔡宇,杨隽,姜杰玲,等C 外周血联合脐血模式单倍体异基因造血干细胞移植治疗恶性血液病C 中华器官移植杂志,2018,39,(06);327-332
3、Todd JA. Stem cells and a cure for type 1 diabetes? Proc Nat Acad Sci USA 2009;106:15523–4.
4、Zhao Y, Lin B, Dingeldein M, Guo C, Hwang D, Holterman MJ. New type of human blood stem cell: a double-edged sword for the treatment of type 1 diabetes. Transl Res 2010;155:211–6